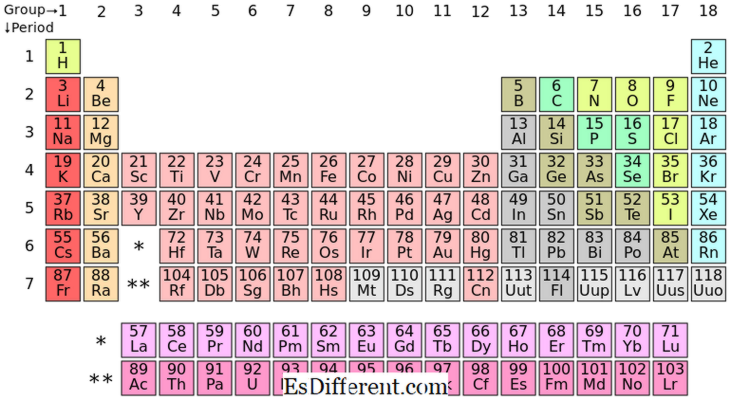
Diferența dintre elementele blocului S și P | S vs P Elemente de bloc
vs. Elemente de bloc P
Diferența cheie între elementele blocului s și p poate fi explicată cel mai bine folosind configurația lor electronică. În elementele blocului s, ultimul electron se umple la subshell-ul s și în elementele blocului p, ultimul electron se umple la subshellul p. Când formează ioni; Elementele blocului de blocaj scoate electronii lor din subshell-ul exterior, cu ușurință, în timp ce elementele blocului p acceptă electroni în subsetul p sau îndepărtează electronii din subshellul p. Unele elemente din grupul p formează ioni pozitivi care îndepărtează electronii din subsetul p-exterior și unele elemente (elementele cele mai electronegative) formează ioni negativi care acceptă un electron de la ceilalți. Când luați în considerare proprietățile chimice, există o diferență semnificativă între elementele blocului s și p; acest lucru se datorează în principal configurației de electroni.
Ce sunt elementele S-bloc?
Elementele S-bloc sunt elementele chimice din grupa I și grupa II din tabelul periodic. Deoarece subshell-ul s poate găzdui doar doi electroni, aceste elemente au de obicei un singur electron (grupa I) sau doi (grupa II) în cochilia exterioară. Elementele din grupurile I și II sunt prezentate mai sus în tabel.
- diff Articolul Mijloc înainte de masă| IA | II A | |
| 2 | Li | Be |
| 3 < K | Ca | 5 |
| Rb | Sr | 6 |
| Cs | Ba | 7 |
| Fr | Ra | - |
| IA | Metalele alcaline | II A |
| Toate elementele din s-bloc formează ioni pozitivi și sunt foarte reactivi. | Plasarea elementelor S-bloc în tabelul periodic |
| |
Ce sunt elementele blocului P? |
Elementele P-bloc sunt elementele ale căror ultim electron se umple în subsolul p. Există trei p-orbitale; fiecare orbital poate găzdui doi electroni, făcând un total de șase electroni p. Prin urmare, elementele p-bloc au unul la șase electroni p în cochilia lor exterioară. Blocul P conține atât metale, cât și nemetale; în plus, există și unele metaloide.
13
1415
16
| 17 | 18 | 2 | B | C | N | |
| O | F Ne | 3 | Al | Si | P | S |
| Cl | Ar | 4 | Ga | Ge | Ca | Se |
| Br | Kr | 5 | În | Sn | Sb | Te |
| I | Xe | 6 | Tl | Pb Bi | Po | La |
| Rn | Care este diferența dintre elementele blocate S și P? | Elemente S-bloc: | Elementele S-bloc au configurația electronică comună a gazului nobil | 1 | (pentru elementele din grupa I)] ns | 2 |
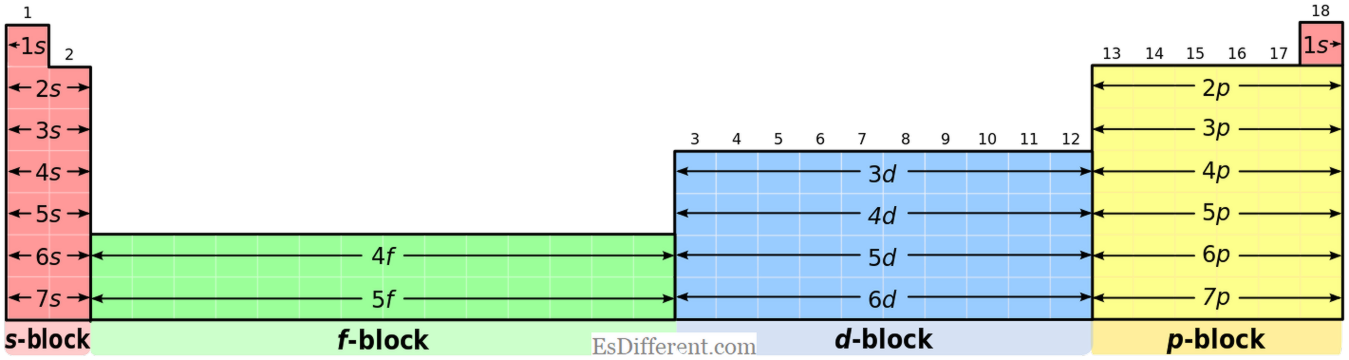
(pentru elementele grupului II).
Elemente P-bloc:
Elementele blocului P au configurația electronică comună a gazului nobil 2 np 1-6 . Dar, heliul are configurația 1s 2
; este o situație specială. Statele de oxidare: Elementele S-bloc: Elementele S-bloc nu prezintă multiple stări de oxidare, cum ar fi elementele p-bloc. De exemplu, elementele din grupa I prezintă +1 stare de oxidare și elementele grupului II prezintă o stare de oxidare +2. Elemente P-bloc: Spre deosebire de elementele s-bloc, elementele p-bloc au o stare obișnuită de oxidare pentru grupul lor în tabelul periodic și câteva alte stări de oxidare suplimentare în funcție de stabilitatea ionului. Grup 13
14
15 16
17 18



