Diferența dintre presiunea parțială și presiunea de vapori Diferența dintre
Presiunea parțială și presiunea de vapori sunt utilizate în mod obișnuit termeni științifici referitori la cantitatea de presiune exercitată de componentele sistemului, dar identitatea lor poate fi confuză pentru ceilalți. Există o distincție clară între acești termeni, inclusiv efectele și identitatea acestora. Acest articol va elabora mai mult diferențele dintre acești termeni. Acesta va include, de asemenea, câteva exemple de demistificare a aplicațiilor.
Să începem prin a sublinia conceptul de presiune înainte de a putea să ne îndreptăm spre deosebirea dintre vapori și presiunea parțială. Presiunea este definită științific ca forța aplicată pe unitatea de suprafață a unui obiect sau a unei substanțe. Acesta poate fi de asemenea definit ca forța aplicată de particulele de coliziune unele pe altele și este adesea măsurată folosind Pascal. În cazul coliziunii particulelor, se utilizează ecuația gazului și teoria cinetică a gazelor pentru a calcula presiunea.
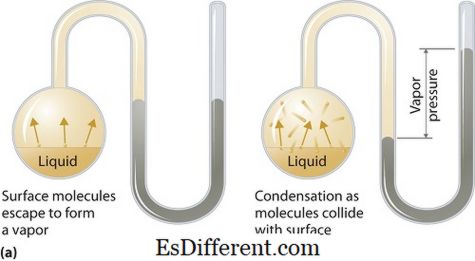
Ce este presiunea vaporilor?
Presiunea de vapori se poate aplica fazelor lichide sau solide. Este presiunea exercitată de vapori în echilibrul său termodinamic în stare lichidă sau solidă la o temperatură dată într-un sistem închis atunci când atât vaporii cât și lichidul (solidul) sunt în contact. Această presiune apare ca urmare a vaporizării, care este posibilă prin creșterea căldurii pe lichid sau solid. Astfel, temperatura este folosită ca măsură de vaporizare și este direct proporțională cu presiunea de vapori. Aceasta înseamnă că cu cât este mai mare temperatura, cu atât este mai mare presiunea de vapori.
În timpul vaporizării, moleculele de aer evoluează ca urmare a unei energii cinetice mai înalte la aer într-un sistem închis. Apoi, când este în echilibru, presiunea de vapori are loc între vapori și forma condensată de lichid (solid). În soluțiile în care forțele intermoleculare sunt mai slabe, presiunea vaporilor tinde să fie mai mare și, invers, în soluțiile în care forțele intermoleculare sunt mai puternice, presiunea de vapori este mai mică.
Presiunea de vapori poate să apară și în amestecuri ideale, după cum explică legea lui Raoult. Se precizează că presiunea parțială a vaporilor unei componente particulare într-un amestec lichid sau solid este egală cu presiunea de vapori a componentei înmulțită cu fracția sa molară în amestecul respectiv la o temperatură dată. Exemplul de mai jos va ilustra acest lucru.
Exemplul 1.
Având în vedere un amestec ideal de 0,5 mol. etanol și 1,5 mol. metanol cu presiunea de vapori de 30KPa și respectiv 52KPa determină presiunea parțială a vaporilor fiecărei componente.
Soluție:
Numărul total de moli este 1. 5mol + 0. 5mol = 2. 0mol. Conform legii Raoult, presiunea parțială a vaporilor este egală cu presiunea de vapori înmulțită cu fracția molară a acelei componente particulare.În acest caz, P metanol = 1,5 / 2 * 52 = 39KPa și P etanol = 0,5/2 * 30 = 7,5KPa.
Când aveți presiunea parțială de vapori a componentelor din amestec, puteți obține presiunea totală a vaporilor adăugându-le împreună. Din acest punct de vedere, 7,5 + 39 dă 46. 5 KPa presiunea totală a vaporilor amestecului de soluții de etanol și metanol.
Factorii care afectează presiunea de vapori
Identitatea moleculelor
După cum sa menționat deja mai sus, tipurile de forțe moleculare determină cantitatea de presiune a vaporilor care trebuie exercitată. Dacă forțele sunt mai puternice, atunci apare mai puțin presiunea de vapori, iar dacă este mai slabă, atunci apare o presiune mai mare de vapori. Prin urmare, compoziția lichidului sau a solidului va afecta presiunea vaporilor.
Temperatura
Temperatura mai mare duce la o presiune mai mare a vaporilor deoarece activează mai multă energie cinetică pentru a rupe forțele moleculare, astfel încât moleculele să poată scăpa repede de suprafața lichidului. Când presiunea vaporilor (presiunea saturată a vaporilor) este egală cu presiunea externă (presiunea atmosferică), lichidul va începe să fiarbă. O temperatură mai scăzută va rezulta cu o presiune scăzută a vaporilor și va dura timp pentru fierberea lichidului.

Legea presiunii parțiale a lui Dalton
Ce este presiunea parțială?
Ideea de presiune parțială a fost inițial propusă de renumitul om de știință John Dalton. Aceasta a dat naștere Legii presiunilor parțiale care afirmă că presiunea totală exercitată de un amestec ideal de gaze este egală cu suma presiunilor parțiale ale gazelor individuale. Spuneți că un recipient special este umplut cu gaze de hidrogen, azot și oxigen, presiunea totală, P TOTAL, va fi egală cu suma oxigenului, azotului și hidrogenului. Presiunea parțială a oricărui gaz din amestecul respectiv se calculează prin înmulțirea presiunii totale cu fracția molară a gazului individual.
Pe scurt, presiunea parțială este presiunea exercitată de un anumit gaz din amestec ca și cum ar acționa singur în sistem. Astfel, ignorați alte gaze atunci când determinați presiunea parțială a unui gaz individual. Această teorie poate fi verificată prin injectarea, de exemplu, a unui strat de O 2 într-un container de 10 litri la 230K și apoi prin injectarea a 0,4atm N 2 într-un recipient identic de aceeași mărime la aceeași temperatură și apoi combinați în cele din urmă gazele pentru a măsura presiunea totală; acesta va fi suma celor două gaze. Acest lucru explică în mod clar presiunea parțială a unui gaz individual într-un amestec de gaze nereactive.
Calculul presiunii parțiale
Pentru a calcula presiunea parțială este o briză absolută, deoarece legea lui Dalton [1] prevede prevederi pentru aceasta. Aceasta va depinde de informațiile tipice furnizate. Dacă, de exemplu, presiunea totală este dată pentru un amestec de gaz A și B, precum și presiunea gazului A, presiunea parțială a lui B poate fi calculată folosind P TOTAL = P A + P B . Restul este manipularea algebrică. Dar într-un caz în care a fost dată numai presiunea totală a amestecului, puteți folosi fracția molară a gazului B pentru a determina presiunea parțială.Fracția molară, notată cu X, poate fi găsită prin împărțirea molilor gazului B la cantitățile totale de amestec de gaze. Apoi, pentru a găsi presiunea parțială, veți multiplica fracția molară, X, la presiunea totală. Exemplul de mai jos explică acest lucru.
Exemplul 2.
Un amestec de azot și oxigen, cu 2,5 mol și respectiv 1,85 moli, este injectat într-un recipient de 20 litri cu o presiune totală de 4 atm; calcula presiunea parțială exercitată de gazul de oxigen.
Soluție:
Numărul total de moli în amestec este 2. 5 + 1. 85 = 4. 35 moli. Astfel, fracția molară a oxigenului, X o , va fi de 1,85 moli / 4. 35 moli = 0,425 moli. Presiunea parțială a oxigenului va fi de 0,425 * 4atm = 1,7atm. Presiunea parțială a gazului rămas poate fi calculată pe baza aceleiași abordări sau poate fi calculată prin utilizarea gazului de oxigen și a presiunii totale elaborate de legea lui Dalton privind presiunile parțiale, conform căreia presiunea totală a gazelor nereactive este egală cu suma presiunile parțiale.
Diferența dintre vapori și presiunea parțială
Din explicațiile de mai sus, este evident că presiunea vaporilor și presiunea parțială sunt două presiuni distincte. Presiunea de vapori se aplică în fazele lichide și solide, în timp ce presiunea parțială se aplică în faza gazoasă. Presiunea de vapori se exercită în faza de tranziție după ce a fost adăugată suficientă căldură la soluție, ceea ce duce la scăderea moleculelor sale într-un sistem închis.
Principala diferență între presiunea parțială și presiunea de vapori este că presiunea parțială este presiunea exercitată de un gaz individual într-un amestec ca și cum ar fi fost singur în acest sistem, în timp ce presiunea de vapori se referă la presiunea exercitată de vapori în echilibrul termodinamic cu starea sa condensată de lichid sau solid. Tabelul de mai jos oferă o comparație concisă a acestor presiuni.
| Presiunea parțială | Presiunea parțială |
| Este exercitată de vapori lichizi sau solizi în faza condensată în echilibru | Se exercită prin gaze individuale într-un amestec de gaz nereactiv |
| Legea | Este bine explicată prin Legea lui Dalton |
| Aplicabilă în fazele solide și lichide | Aplicabilă numai în fazele gazoase |
| Independent de suprafața sau volumul sistemului | volum |
| Calculat folosind fracția molară a substanței dizolvate | Calculat utilizând fracția molară a gazului |
Wrap Up!
Presiunea de vapori și presiunea parțială sunt doi termeni științifici importanți utilizați pentru a determina efectele forțelor aplicate de vapori și, respectiv, de gaze în sistemul închis dat la temperaturi particulare. Principala lor diferență este zona de aplicare cu presiunea de vapori aplicată pe faze lichide sau solide, în timp ce presiunea parțială este aplicată pe un gaz individual într-un amestec de gaze ideale într-un volum dat.
Presiunea parțială se calculează cu ușurință prin respectarea Legii Presiunii Parțiale a lui Dalton, în timp ce presiunea de vapori se calculează prin aplicarea Legii lui Raoult.În orice amestec dat, fiecare componentă gazoasă exercită presiunea proprie, numită presiunea parțială independentă de alte gaze. Și când dublați moli de orice componentă cu temperatura rămasă constantă, veți crește presiunea parțială. Conform relației lui Clausius-Clapeyron [2], presiunea de vapori crește odată cu creșterea temperaturii.
Cu informațiile menționate mai sus, ar trebui să puteți distinge între presiunea vaporilor și presiunea parțială. De asemenea, ar trebui să le puteți calcula utilizând fracțiile molare și să înmulțiți prin presiunea totală. V-am dat exemple tipice pentru a elabora aplicarea acestor presiuni.