Diferența dintre octet și duplet | Octet vs Duplet
Diferența cheie - octet vs duplet
Există atomi sau compuși activi și inactivi chimic prezenți în natură. Această caracteristică este în principal dependentă de numărul de electroni prezenți în cochilii exteriori ai atomilor. Atomii care au carcase incomplete pot deveni activi pentru a-și termina configurația electronilor pentru a deveni stabili. Atomii care sunt inactivi au o configurație electronică completă; astfel, acești atomi nu reacționează cu nici un alt atom decât în condiții speciale. Gazele nobile sunt întotdeauna inactive în natură. Prin urmare, ele sunt cunoscute ca gaze inerte. Gazele inerte se află în coloana a opta din tabelul periodic. Alte elemente din aceeași perioadă (rând) tind să obțină configurația electronică a gazului inert la sfârșitul acelei perioade, care este cea mai stabilă formă în natură. Atomii activi au tendința să completeze numărul de electroni în conformitate cu regula de octet sau cu regula de duplicare . Diferența cheie dintre octet și duplex este că octetul este un atom sau un ion care are maximum opt electroni în carcasa exterioară în timp ce duplet este un atom având maximum doi electroni în carcasa exterioară.
CUPRINS> 1. Prezentare generală și diferență cheie
2. Ce este un Octet
3. Ce este un Duplet
4. Comparație între ele - Octet vs Duplet
5. Rezumat
Ce este un octet?
Un octet este un atom sau un ion care are opt electroni în cochilia exterioară a acelui atom. Toate gazele nobile, cu excepția heliului, au opt electroni și sunt inerte în natură. Configurația electronică a unui gaz nobil se va încheia întotdeauna după cum urmează.
->
ns2 np 6 De exemplu, configurația electronică a neonului este 1s
2 < 2p 6 . Neonul este un gaz inert. Alte elemente care au electroni șapte, șase, etc. în orbita cea mai exterioară tinde să asculte regula octeților prin obținerea de electroni din exterior; unele alte elemente care au unul, doi, etc. electronii tind să-și piardă electronii și să obțină configurația electronică a celui mai apropiat gaz inert. Dar alte elemente din mijlocul mesei periodice vor forma legături noi cu elemente care au exces de electroni pentru a împărți acești electroni și a deveni un octet.
Atomul de hidrogen și atomul de heliu sunt cele mai mici elemente din natură și au o singură orbitală în jurul nucleului lor. Această orbitală se numește orbitală 1s. Această orbitală poate conține maximum doi electroni. Atomul de hidrogen are un electron și heliul are doi electroni. Prin urmare, heliul este numit un duplex.Heliul are numărul maxim de electroni pe care îl poate avea; astfel este un element stabil în natură. Prin urmare, heliul este, de asemenea, un gaz inert. Dar hidrogenul are doar un singur electron și singurul orbital pe care îl are este incomplet. Astfel, atomul de hidrogen singur este foarte reactiv și tinde să formeze o legătură covalentă cu un alt atom de hidrogen prin împărțirea singurelor electroni pe care le au. Apoi, acești atomi de hidrogen devin duplete, deoarece acum au doi electroni în cele mai exterioare orbite. Dar, litiul se poate comporta, de asemenea, ca un duplet prin îndepărtarea electronului din orbitalul său exterior. Configurația electronică a litiului este 1s
2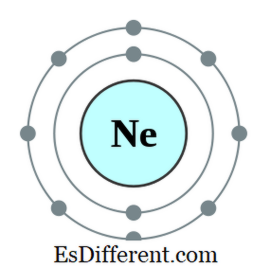
2s
1
. Prin eliminarea electronului 2s 1 , acesta poate deveni un duplex. În acest caz, He, H - și Li + sunt dupleturi care pot exista ca și dupulete stabile. Toate dupuletele au configurație electronică care se termină după cum urmează. ns 2 Figura 02: Heliu, un duplet
Care este diferența dintre Octet și Duplet?
- diff Articol Mijloc înainte de masă -> Octet vs Duplet

Octetul are opt electroni în cochilie.
Duplet are doi electroni în cochilie.
Configurația electronică obișnuită
Octetul are configurația de electroni ns |
|
| 2 | np |
| 6 | |
| . Duplet are ns 2 configurație tip la sfârșit. Numărul de orbite | Octetul poate avea cel puțin două orbite. Un duplet are o singură orbitală. Tipul de orbite |
| Un octet poate avea toate tipurile de orbite cum ar fi s, p, d, f, etc. | |
| Duplet are doar s orbital. | Rezumat - Octet vs. Duplet |
| Toate elementele tind să devină stabile. Dar, cu configurații electronice incomplete, atomii nu pot fi stabili; astfel, ele devin foarte reactive pentru a umple cochilii cu electroni prin câștigarea, pierderea sau împărțirea electronilor. Atomii sau moleculele care respectă regula octetului sau dubletului sunt stabile. Diferența esențială dintre octet și duplet este aceea că octetul are opt electroni în orbitalul său ultraperiferic, în timp ce dupletul are doi electroni în orbitalul său. | |
| Referințe: | 1. Nema, P., 2011. Topperlearning. [Online] Disponibil la: // www. topperlearning. com / forums / home-work-help-19 / ce-este-octet-duplet-valență-și-ioni-chimie-structure-of-the-atom-46317 / reply [Accesat 29 05 2017]. |
2. Chang, R., 2010. Chimie. 10 ed. New York: McGraw-Hill.
3. Anon., 2015. Stivuitor cu grad. [Online] Disponibil la adresa: // gradestack. com / NTSE-completă-curs / chimic-lipire / activitate chimică-activitate-an / 19176-3853-37737-studiu-wtw [accesat 29 05 2017].
Amabilitatea imaginii:
1. "Coșul de electroni 002 Helium - fără etichetă" Prin Pumbaa (lucrare originală de Greg Robson) - Diagrame de coajă electronică (versiunea etichetă corespunzătoare) (CC BY-SA 2. 0 uk) prin Commons Wikimedia
2. "Electron shell 010 Neon" De Pumbaa (lucrare originală de Greg Robson) (CC BY-SA 2. 0 uk) prin Commons Wikimedia




