Diferența dintre metan și etan | Metan vs Ethan
vs Ethane
Metanul și etanul sunt cei mai mici membri ai familiei de alcani. Formulele moleculare ale acestor doi compuși organici sunt CH 4 și respectiv C 2 H 6 . Diferența cheie între metan și etan este structura lor chimică ; o moleculă de Etan poate fi considerată ca două grupe metil legate ca dimer de grupări metil. Celelalte diferențe chimice și fizice apar în principal din cauza acestei diferențe structurale.
Ce este metanul?
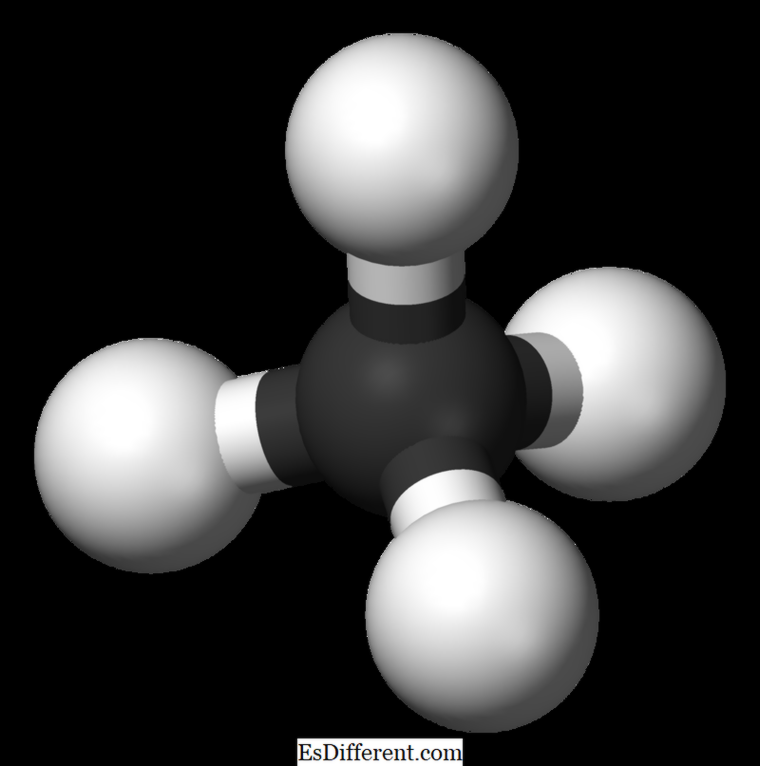
Metanul este cel mai mic membru al familiei de alcani cu formula chimică CH 4 (patru atomi de hidrogen sunt legați la un atom de carbon). Se consideră a fi componenta principală a gazelor naturale. Metanul este un gaz incolor, inodor și fără gust; de asemenea, cunoscut sub numele de carban, gaz de mlaștină, gaz natural, tetrahidrură de carbon, și carbură de hidrogen . Poate fi ușor aprins, iar vaporii sunt mai ușor decât aerul.
Metanul se găsește în mod natural sub pământ și sub podeaua mării. Metanul atmosferic este considerat un gaz cu efect de seră. Metanul se descompune în CH 3 - cu apă în atmosferă.
Ce este Ethan?
Etanul este un compus gazos incolor, inodor, la temperatură și presiune standard. Formula moleculară și greutatea moleculară sunt C 2 H 6 și respectiv 30,07 g · mol -1 . Este izolat de gaze naturale, ca un produs secundar din procesul de rafinare a petrolului. Etanul este foarte important în producția de etilenă.

Care este diferența dintre metan și etan?
Caracteristicile metanului și etanului
Structura:
Metan: Formula moleculară a metanului este CH 4, a unei molecule tetraedrice cu patru legături CH echivalente (legături sigma). Unghiul de legătură între atomii H-C-H este 109. 5 0 și toate legăturile C-H sunt echivalente și este egal cu 108. 70 pm. Ethan:

Formula moleculară a etanului este C 2 H 6, conține obligațiuni multiple. Proprietăți chimice:

Metan:
Stabilitate:
Metanul este o moleculă chimică foarte stabilă care nu reacționează cu KMnO 4 2 O 7 , H 2 SO 4 sau HNO 3 . Combustie: În prezența aerului în exces sau a oxigenului, metanul arde cu o flacără albastră deschisă, care produce dioxid de carbon și apă.Este o reacție extrem de exotermă; prin urmare, este folosit ca un combustibil excelent. În prezența aerului sau a oxigenului insuficient, acesta arde parțial în gazul de monoxid de carbon (CO). Reacții de substituție: Metanul prezintă reacții de substituție cu halogeni. În aceste reacții, unul sau mai mulți atomi de hidrogen sunt înlocuiți cu un număr egal de atomi de halogen și se numește "halogenare. "Reacționează cu clorul (Cl) și bromul (Br) în prezența luminii solare.
Reacția cu abur: Când un amestec de metan și abur trece printr-un nichel încălzit (1000 K), susținut pe suprafața de alumină, acesta poate produce hidrogen.
Piroliza: Când metanul este încălzit la circa 1300 K, acesta se descompune la negru de fum și hidrogen.
Ethan: Reacții:
Gazul etanic (CH 3
CH
3 ) reacționează cu vapori de brom în prezența luminii pentru a forma brometan > 3 CH 2 Br) și bromură de hidrogen (HBr). Este o reacție de substituție; un atom de hidrogen în etan este substituit cu un atom de brom. CH 3 CH 3 + Br
2 aCH 3 CH 2 Br + HBr Combustie: Combustia completa a etanului produce 1559. 7 kJ / mol (51,9 kJ / g) de caldura, dioxid de carbon si apa. 2C 2 H 6
+ 7 O
2 → 4 CO 2 + > H 2 O + 3120 kJ De asemenea, poate apărea fără un exces de oxigen, producând un amestec de carbon amorf și monoxid de carbon. 2 C 2 H 6 + 3 O
2
+ energie 2C 2 H 6 + 5 2 O + energie 2C 2
H H 2 O + energie etc. Definiții: Reacții de substituție: Reacția de substituție este o reacție chimică care implică deplasarea unui grup funcțional într- l înlocuiește cu un alt grup funcțional. Utilizări: Metan:
Metanul este utilizat în multe procese chimice industriale (drept combustibil, gaz natural, gaz natural lichefiat) și este transportat ca lichid refrigerat. Ethan: Etanul este utilizat drept combustibil pentru motoare și ca agent frigorific pentru un sistem cu temperaturi extrem de joase. Se livrează în cilindri din oțel sub formă de gaz lichefiat sub presiunea proprie de vapori. Referințe: "Ethan". Wikipedia . N. p., 2016. Web. 7 iunie 2016. Khanna, Bhișm. "Care sunt proprietățile chimice ale metanului? “. Preservearticles. com . N. p., 2016. Web. 7 iunie 2016. "Metan | CH4 - Pubchem ". Extract. NCBI. NLM. nih. gov . N. p., 2016. Web. 7 iunie 2016. "Metan". Wikipedia . N. p., 2016. Web. 7 iunie 2016. Imagine cu amabilitate: Modelul "minge-și-stick de molecula de metan" de către (Domeniul Public) prin Wikimedia Wikimedia "Modelul mingii și bățului moleculei de etan" Ben Mills - "Metan" De Jynto - Lucrare proprie, bazată pe fișier: Metan-CRC-MW-dimensiuni-2D.png, (Domeniul Public) prin Wikimedia Wikimedia "Ethane" (Domeniul Public) prin Wikimedia Wikimedia


