Diferența dintre electroni de Valency și Valence | Valencia vs Valence Electrons
Diferențele cheie - Valencius vs Electronii Valence
Electronii de valență și electronii de valență sunt termeni interdependenți, iar diferența cheie între electronii valenței și valenței este cel mai bine explicată în definițiile lor; electronii de valență sunt electronii din cochilia exterioară a unui element în timp ce electronii de valență reprezintă numărul de electroni care trebuie să fie acceptați sau îndepărtați pentru a obține cea mai apropiată configurație de gaz nobil < >. Este vorba de electronii din cochilie, care de obicei contribuie la formarea legăturilor chimice. La unii atomi, numărul de electroni de valență este egal cu numărul de electroni de valență. Ce sunt electronii V
? Numărul de electroni din cochilia exterioară a unui atom se numește "electroni de valență". Din acest motiv, învelișul exterior al unui atom se numește "coajă de valență". De cele mai multe ori, acestea sunt electronii care iau parte la legarea chimică. Când elementele formează cationi, elimină electronii din cochilia de valență. Numărul de electroni de valență dintr-un element determină grupul din tabelul periodic.
Ce sunt electronii Valency?

(999)> Pentru elementele metalice,
Numarul de Electroni de Valency = Numarul de electroni de Valence (Ei elimina electronii)
|
Exemplul
Electronii de Valency:
Numarul de electroni care trebuie acceptati sau eliminati pentru a obtine configuratia electronica a celui mai apropiat gaz nobil se numeste "electroni de valenta" sau "valenta" unui atom. În general, pentru elementele metalice (elementele din grupa I, II și III), numărul de electroni de valență este egal cu numărul de electroni de valență; ei îndepărtează electronii din cochilia de valență pentru a obține structura octetului.
Dar elementele nemetalice acceptă electroni pentru a obține configurația electronică a celui mai apropiat gaz nobil. Prin urmare, valența elementelor nemetalice se calculează prin scăderea electronilor valenței totale de la 8.
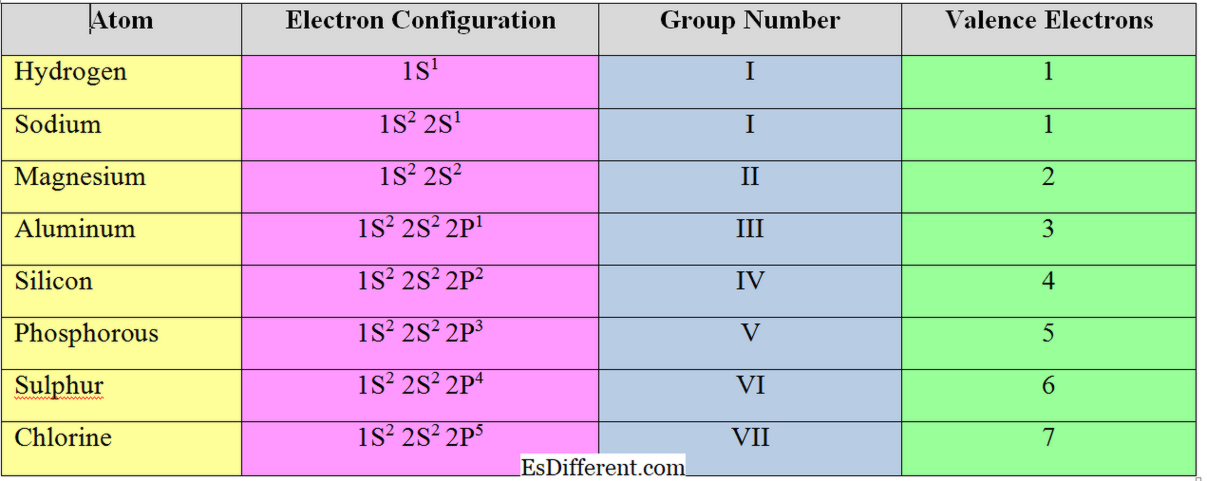
Pentru clor, numărul de electroni de valență = 8-7 = 1 Caracteristicile electronilor de Valency și Valence
Valency și Valence Electronii din elementele grupului VIII
Electronii Valence:
Elementele din grupa VIII sunt gazele nobile și sunt stabile din punct de vedere chimic. Cochilia lor exterioară este completă și conține opt electroni în cochilia exterioară (cu excepția Helium-He); astfel încât electronii din grupa VIII au opt electroni de valență.

Valency Electrons:
Valency este o măsură a capacității de a forma legături cu alte elemente sau molecule. Gazele nobile nu acceptă și nu îndepărtează electronii pentru a atinge regula octetului, deoarece au terminat deja ultima cochilie. Prin urmare, valența elementelor din grupa VII este egală cu zero.
Licența de imagine: "Electron shell 010 Neon - fără etichetă" de către commons: Utilizator: Pumbaa (lucrare originală de către commons: User: Greg Robson) - Wikimedia. org / wiki / Categorie: Electron_shell_diagrams (versiunea corespunzătoare etichetei). (CC BY-SA 2. 0 uk) prin Commons




