Diferența dintre nitrați și nitriți
nitrați vs. nitriți
Atât azotatul cât și nitritul sunt oxi anioni de azot. Deși ambele par să arătă la fel, există diferențe între ele. Aceste diferențe pot fi legate de structura, legătura, forma geometrică, starea de oxidare a azotului, reactivitatea chimică, utilizările acestora etc. Aceste diferențe sunt discutate mai ales aici.
-3 - ionul este baza conjugată a HNO 3 (acidul nitric V) care este un acid puternic. Este o moleculă planificatoare cu hibridizare sp 3 în atomul de azot. Toți cei trei atomi de oxigen sunt echivalenți. Există 24 de electroni în cochilii de valență. NO 3 - ion are greutatea moleculară de 62,004 g mol -1 . NO
2 - ionul este baza conjugată a HNO 2 (acid nitric III) care este un acid slab (pKa = 3,5). Este, de asemenea, o moleculă planificatoare cu hibridizare sp 2 . În cochilia de valență există doar 18 electroni. NOx 2 - ion are greutatea moleculară de 46,006 g mol -1 . Atunci când se ia în considerare legarea în ambii ioni, în legăturile NO
3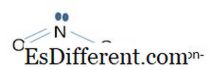

- , legarea pi implică patru orbite atomice 2p z orbitla din N și trei orbite din 3 atomi de oxigen). Aceste patru orbite atomice formează 4 orbite moleculare pi centrate pe patru axe. Orbitalul molecular cu cea mai mică energie este orbitalul de legătură. Orbitalul cu cea mai mare energie este orbitalul anti-lipire. Alte două orbite sunt degenerate (egale în energie) care sunt orbite nelegate. În cazul ionului NO 2 - , legarea pi implică doar trei orburi atomice 2p z . Aici, orbitalul cu cea mai mică energie este orbitalul de legătură, cel mijlociu este orbital nelegat, iar celălalt este orbitalul anti-lipire. În ambele ioni, orbitele de legare implică în realizarea legăturilor σ (legătura sigma) și a orbitalilor nelegați în implicarea în realizarea legăturilor π (legăturile pi). Prin urmare, în legăturile NO 3 - fiecare legătură are o ordine de obligațiuni de 1 1 / 3 . 1 de la σ-obligațiune și 1 / 3 de la legăturile π. În ordinul de obligațiuni NO 2 - , ordinea obligațiunilor este 1 1 / 2 . 1 de la σ-obligațiune și 1 / 2 de la legăturile π.
- are o formă de planor triunghiular și ionul NO 2 - are o formă unghiulară (sau forma V . Unghiurile de legătură sunt, de asemenea, diferite. ONO unghiul de legătură de ioni NO 3 - ion și NO 2 - sunt 120 0 și 115 0 respectiv. Starea de oxidare a azotului în ionul de ioni de NO 3 - și de 2 - este de +5, respectiv +3.Datorită acestor motive (în special diferența de legare), reactivitatea chimică (cum ar fi bazicitatea, capacitatea de oxidare / reducere, produsele de descompunere termică a compușilor constă din acești ioni) este, de asemenea, diferită. În practică, ionul NO 2
- este o bază mai slabă, în timp ce ionul NO 3 - este o bază foarte slabă. Când se ia în considerare starea de oxidare a atomului de azot în acești ioni, ionul de NO 2 - poate acționa ca un agent reducător, precum și un agent de oxidare în timp ce NO 3 - ionul poate acționa numai ca agent de oxidare. Exemplele de produse obținute prin descompunerea termică a compușilor care conțin compuși cu NO 3

- și NO 2 - sunt prezentate mai jos pentru a arăta diferența de reactivitate. Chiar și atunci când formează complexe cu ioni metalici, ele se comportă diferit. Acesta este un ion care acționează ca un ligand monodentat, în timp ce ionul NO 3

- acționează ca un ligand bidentat. Aceste diferențe în reactivitatea chimică ne ajută să diferențiem utilizările acestora. De exemplu, nitriții sunt utilizați în general în prelucrarea cărnii (uneori se utilizează și nitrați), iar nitrații sunt utilizați pentru producerea de explozivi. Nitrații sunt naturali și sunt canceroși. Dar nitriții nu sunt canceroși.


