Diferența dintre enzimă și coenzima | Enzima vs Coenzima
Diferența cheie - enzima vs coenzima
Reacțiile chimice transformă unul sau mai multe substraturi în produse. Aceste reacții sunt catalizate de proteine speciale numite enzime. Enzimele acționează ca un catalizator pentru majoritatea reacțiilor fără a fi consumate. Enzimele sunt fabricate din aminoacizi și au secvențe de aminoacizi unice compuse din 20 de aminoacizi diferiți. Enzimele sunt susținute de molecule mici non-proteice organice numite cofactori. Coenzimele sunt un tip de cofactori care ajută enzimele să efectueze cataliză. Diferența cheie între enzimă și coenzima este că enzima este o proteină care catalizează reacțiile biochimice în timp ce coenzima este o moleculă organică care nu proteinează și care ajută enzimele să activeze și să catalizeze reacțiile chimice. Enzimele sunt macromolecule, în timp ce coenzimele sunt molecule mici.
CUPRINS> 1. Prezentare generală și diferență cheie
2. Ce este o enzimă
3. Ce este un coenzima
4. Comparație între ele - Enzima vs Coenzima
5. Rezumat
Ce este o enzimă?
Enzimele sunt catalizatori biologici ai celulelor vii. Sunt proteine compuse din sute până la milioane de aminoacizi atașați împreună ca perlele pe un șir. Fiecare enzimă are o secvență unică de aminoacizi și este determinată de o genă specifică. Enzimele accelerează aproape toate reacțiile biochimice din organismele vii. Enzimele influențează numai rata reacției și prezența lor este esențială pentru inițierea conversiei chimice, deoarece energia de activare a reacției este redusă de enzime. Enzimele modifică rata reacției fără a fi consumată sau fără a schimba structura chimică. Aceeași enzimă poate cataliza conversia mai multor substraturi în produse prin demonstrarea abilității de a cataliza aceeași reacție din nou și din nou.
Reacțiile enzimatice sunt afectate de mai mulți factori, cum ar fi pH-ul, temperatura etc. Fiecare enzimă are o valoare optimă a temperaturii și o valoare a pH-ului pentru a funcționa eficient. Enzimele interacționează, de asemenea, cu cofactori non-proteici, cum ar fi grupuri protetice, coenzime, activatori etc., pentru a cataliza reacțiile biochimice. Enzimele pot fi distruse la temperaturi ridicate sau prin aciditate sau alcalinitate ridicată, deoarece sunt proteine.
Figura 01: Model de inducere a activității enzimatice.Ce este o coenzima?

Reacțiile chimice sunt ajutate de molecule non-proteice numite cofactori. Cofactorii ajută enzimele să catalizeze reacțiile chimice. Există diferite tipuri de cofactori și coenzime sunt unul dintre ele. Coenzima este o moleculă organică care se combină cu un complex de substrat enzimatic și ajută la procesul de cataliză a reacției. Ele sunt, de asemenea, cunoscute ca
molecule helper
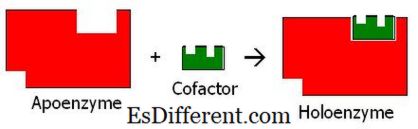
. Ele sunt alcătuite din vitamine sau derivate din vitamine. Prin urmare, dietele ar trebui să conțină vitamine care asigură coenzimele esențiale pentru reacțiile biochimice. Coenzimele se pot lega cu situsul activ al enzimei. Ele se leagă în mod liber cu enzima și ajută reacția chimică prin furnizarea de grupări funcționale necesare pentru reacție sau prin modificarea conformației structurale a enzimei. Prin urmare, legarea substratului devine ușoară, iar reacția conduce spre produse. Unele coenzime acționează ca substraturi secundare și devin modificate chimic la sfârșitul reacției, spre deosebire de enzime. Coenzimele nu pot cataliza o reacție chimică fără o enzimă. Ele ajută enzimele să devină active și să își îndeplinească funcțiile. Odată ce coenzima se leagă de apoenzima, enzima devine o formă activă a enzimei numită holoenzimă și inițiază reacția.
Exemple de coenzime sunt adenozin trifosfat (ATP), nicotinamidadinină dinucleotidă (NAD), dinucleotidă adenină de tip Flavin (FAD), coenzima A, vitaminele B1, B2 și B6 etc. apoenzima
Care este diferența dintre enzime și coenzima?
- diff Articol Mijloc înainte de masă ->
Enzima vs coenzima
Enzimele sunt catalizatori biologici care accelerează reacțiile chimice.
Coenzimele sunt molecule organice care ajută enzimele să catalizeze reacțiile chimice.
Tipul molecular |
|
| Toate enzimele sunt proteine. | Coenzimele nu sunt proteine. |
| Modificări datorate reacțiilor | |
| Enzimele nu sunt modificate datorită reacției chimice. | Coenzimele devin modificate chimic ca urmare a reacției. |
| Specificitatea | |
| Enzimele sunt specifice. | Coenzimele nu sunt specifice. |
| Dimensiunea | |
| Enzimele sunt molecule mai mari. | Coenzimele sunt molecule mai mici. |
| Exemple | |
| Amilaza, proteinaza și kinaza sunt exemple de enzime. | NAD, ATP, coenzima A și FAD sunt exemple de coenzime. |
| Rezumat - Enzima vs Coenzima | |
| Enzimele catalizează reacțiile chimice. Coenzimele ajută enzimele să catalizeze reacția prin activarea enzimelor și furnizarea de grupări funcționale.Enzimele sunt proteine compuse din aminoacizi. Coenzimele nu sunt proteine. Ele provin în principal din vitamine. Acestea sunt diferențele dintre enzimele și coenzimele. | Referință: |
1. „enzime. "RSC. N. p., n. d. Web. 15 mai 2017..
2. "Biochimie structurală / enzime / coenzime. "Biochimie structurală / Enzime / Coenzime - Wikibooks, cărți deschise pentru o lume deschisă. N. p., n. d. Web. 15 mai 2017..
Amabilitatea imaginii:
1. "Diagrama de potrivire indusă" creată de TimVickers, vectorizat de Fvasconcellos - furnizat de TimVickers (Domeniul Public) prin Wikimedia Wikimedia
2. "Enzymes" de Moniquepena - Activitate proprie (Public Domain) prin Wikimedia Wikimedia



