Diferența dintre elemente de bloc D și elemente de tranziție | D Elemente de bloc vs. elemente de tranziție
Diferența cheie - Elemente de bloc D vs elemente de tranziție
elementele sunt destul de confuze. Ambele cuvinte sunt folosite interschimbabil și mulți oameni folosesc cuvântul "elemente de tranziție" pentru elementele d-bloc. Diferența cheie între elementele de blocare D și elementele de tranziție este că în timp ce toate elementele de tranziție sunt elemente D-bloc , . Este clar că elementele d-bloc au d-electroni în carcasa d-sub. Elementele tranzițiilor sunt elementele care formează ioni stabili, având incomplet umplut d -orbitale. De exemplu, Zinc și Scandium sunt elemente d-bloc; dar nu și elemente de tranziție.
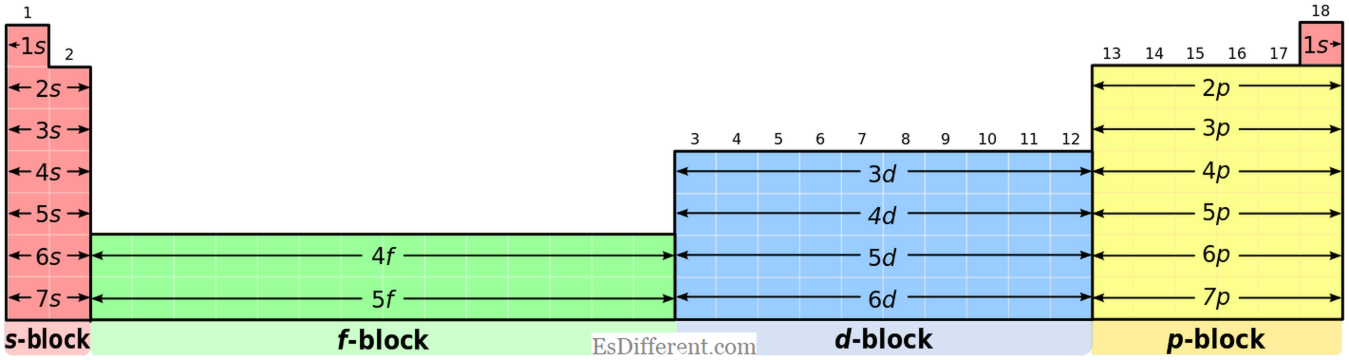
Ce suntElemente D-bloc? Elementele D-bloc pot fi identificate în mod clar utilizând configurația electronică și poziția tabelului periodic. Caracteristica principală a elementului d-bloc are cel puțin un electron în subcâmpul

d-. Lucru ciudat se întâmplă când umplerea electronilor conform principiului Aufbau în elementele d-bloc este, 4s -electronele sunt umplute mai întâi înainte de 3d -electrons; ceea ce înseamnă că 3d-elctronii au o energie mai mare decât electronii 4s. Dar, atunci când elimină electronii pentru a forma ioni; 4s -electronii sunt mai întâi eliminați de la atom.
| Configurație electronică | Scandiu | |
| Sc | Titanium | 1 4s Ti |
| [Ar] 3d | 2 | 4s 2 Vanadium V |
| crom | Cr [Ar] 3d 5 4s | |
| 1 | 2 Feros Fe [Ar] 3d | |
| 6 | 4s | 2 Cobalt Co |
| 4s | 2 | Nichel Ni [Ar] 3d 8 |
| 4s | 2 | Cu 10 4s |
| 1 | Zinc | Zn |
| 2 | - | 2 2s 2 2s |
| 6 | 3s | 2 3p 6 Care sunt elementele de tranziție? |
s -electronii (n-nivel) și apoi elimină d -electronii (nivelul n-1). Zincul și Scandiul sunt două elemente speciale în d-bloc; ele nu formează ioni care au umplut incomplet d -orbitali; prin urmare, acestea nu sunt considerate elemente de tranziție.Toate celelalte elemente din grupul d formează ioni stabili, care au umplut incomplet d -electroni. Soluții metalice de tranziție Care este diferența dintre elementele de bloc D și elementele de tranziție? Definiția elementelor D-bloc și a elementelor de tranziție
Elemente D-bloc:
Elementele care au unul sau mai multe d- electroni în subcoperta d- sunt cunoscute ca elemente d-bloc. Cele mai multe elemente d-bloc sunt metalele. Elementele de tranziție: Elementele care pot forma ioni stabili cu incomplet umplut d -orbitali sunt numiți elemente de tranziție.

Notă:
Zn și Sc nu sunt elemente de tranziție. Ei nu formează numai ioni Zn
2+
și Sc 3+, care nu conțin d-orbitale necompletate. Zn 2+ = 1s
2 2s 2 2p
6
3s 2 3p 6 3d
10 Sc 3+ = 1s 2 2s 2 2p 6 3s 2 3p 6 3d
10 Următorii ioni conțin d-orbitale necompletate. Prin urmare, aceste elemente sunt considerate elemente de tranziție. Cu 2+ = 1s 2 2s 2 2p 6 3s 2 3p 6
3d
9 Ni 4+ = 1s 2 2s 2 2p 6 3s 2 3p 6 3d
6 Mn 2+ 3s 2 3p 6 3d 5 Fe 2+ 1s 2
2s 2 2p 6 3s 2 3p 6 3d 6 a elementelor blocului D prezintă multiple stări de oxidare și puține dintre ele prezintă o singură stare de oxidare. Exemplu: Zincul arată doar o stare de oxidare +2 și Scandium arată doar o stare de oxidare +3. Alte elemente din blocul d prezintă mai multe stări de oxidare.
Elemente de tranziție: Elementele de tranziție prezintă mai multe stări de oxidare. Cel puțin o stare conține neobligate d -orbitale. Exemplu: Titan +2, +4 Vanadiu +2, +3, +4, +5 Crom +2, +3, +6 , +4, +6, +7 Fero +2, +3 Cobalt +2, +3 Nichel +2, +4 Cupru +1, +2 :
1. "Blocuri de tabele periodice spdf (coloana 32)" de către Utilizator: DePiep [CC BY-SA 3. 0] prin Commons
2. "Soluții colorate de tranziție-metale" [Public Domain] prin intermediul Commons