Diferența dintre Alpha Helix și Beta Pleated Sheet | Alpha Helix și Beta Pleated Sheet
Diferența cheie - Alfa Helix vs Beta pliabil Sheet
Heliile alfa și foile pliate beta sunt cele două structuri secundare cele mai frecvent întâlnite într-un lanț polipeptidic. Aceste două componente structurale sunt primii pași principali în procesul de pliere a unui lanț polipeptidic. Diferența cheie între Alpha Helix și Beta Pleated Sheet este în structura ; au două forme diferite pentru a face o anumită activitate.
Ce este Alpha Helix?
O helix alfa este o bobină de dreapta a resturilor de aminoacizi pe un lanț polipeptidic. Gama de resturi de aminoacizi poate varia de la 4 la 40 de resturi. Legăturile de hidrogen formate între oxigenul grupului C = O din bobina de sus și hidrogenul grupului N-H al bobinei inferioare ajută la menținerea bobinei împreună. O legătură hidrogen este formată pentru fiecare patru resturi de aminoacizi din lanț în modul de mai sus. Acest model uniform oferă caracteristici definite, cum ar fi grosimea bobinei, și dictează lungimea fiecărei ture complete de-a lungul axei de helix. Stabilitatea structurii alfa helix depinde de mai mulți factori.

Atomii O în roșu, atomii de N în albastru și legăturile de hidrogen sub forma unor linii punctate verde
Ce este Beta plisată?
Foaia plată beta, cunoscută și sub numele de foaie beta, este considerată a doua formă de structură secundară în proteine. Acesta conține benzi beta care sunt conectate lateral cu cel puțin două sau trei legături de hidrogen în coloana vertebrală pentru a forma o foaie răsucită, plată, așa cum se arată în imagine. O catenă beta este o întindere a lanțului polipeptidic; lungimea sa este în general egală cu 3 până la 10 aminoacizi, inclusiv coloana vertebrală într-o confirmare extinsă.
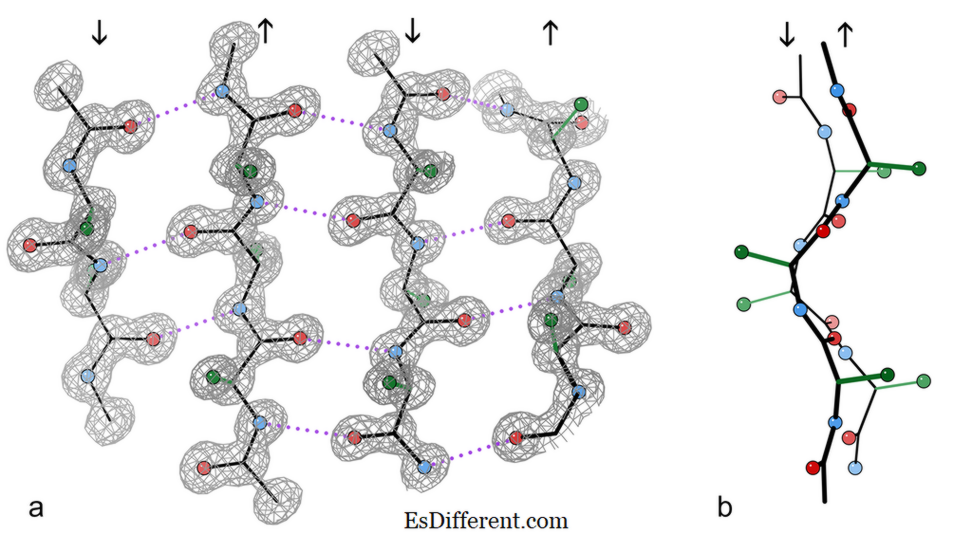
Fragment de foi antiparalel 4-catenare de la o structură de cristal a enzimei catalază.
a) prezentând legăturile de hidrogen antiparalel (punctate) între grupările peptidice NH și CO pe catenele adiacente. Săgețile indică direcția lanțului, iar contururile de densitate electronică conturează atomii non-H. Atomii O sunt bile roșii, atomii de N sunt albastru, iar atomii de H sunt omise pentru simplitate; lateralele laterale sunt afișate numai la primul atom C al lanțului lateral (verde)
b) Vedere în sus a celor două toroane centrale β
În foile pliate beta, lanțurile polipeptidice se execută alături. Se numește "foaie plisată" datorită aspectului de structură al valului. Ele sunt legate între ele prin legături de hidrogen.Această structură permite formarea mai multor legături de hidrogen prin întinderea lanțului polipeptidic.
Care este diferența dintre Alpha Helix și Beta Pleated Sheet?
Structura alfabetelor Helix și Beta pliabile
Alfa Helix:
În această structură, structura polipeptidică este strâns legată în jurul unei axe imaginare ca structură spirală. Este de asemenea cunoscut ca aranjamentul helicoidal al lanțului peptidic.
Formarea structurii alfa helix se întâmplă atunci când lanțurile polipeptidice sunt răsucite într-o spirală. Aceasta permite tuturor aminoacizilor din lanț să formeze legături de hidrogen (o legătură între o moleculă de oxigen și o moleculă de hidrogen) între ele. Legăturile de hidrogen permit helixului să mențină forma spirală și dă o bobină strânsă. Această formă spirală face ca helixul alfa să fie foarte puternic.
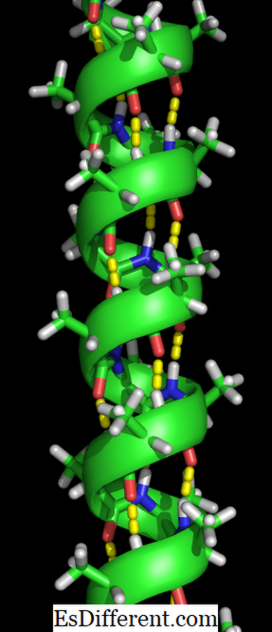
Legăturile de hidrogen sunt indicate prin punctele galbene.
Beta pliabilă:
Atunci când două sau mai multe fragmente de lanțuri polipeptidice se suprapun unul cu celălalt, formând un șir de legături de hidrogen unul cu celălalt, se pot găsi următoarele structuri. Se poate întâmpla în două moduri; aranjament paralel și aranjament anti-paralel.
Exemple de structură:
Helix Alpha: Unghiile sau picioarele de la picioare pot fi luate ca un exemplu de structură alfa helix.
Foaie plată Beta: Structura penei este similară cu structura plăcii beta plisate.
Caracteristicile structurii:
Alfa Helix: În structura alfa helix, există 3,6 aminoacizi pe rotație a helixului. Toate legăturile peptidice sunt trans și planare, iar grupările N-H din legăturile peptidice indică aceeași direcție, care este aproximativ paralelă cu axa helixului. Grupurile C = O ale tuturor legăturilor peptidice indică direcția opusă și sunt paralele cu axa helixului. Grupul C = O al fiecărei legături peptidice este legat la gruparea N-H a legăturii peptidice care formează o legătură hidrogen. Toate grupurile R sunt îndreptate spre exterior din helix.
Foaia plată Beta: Fiecare legătură peptidică din foaia pliată beta este plană și are transconformația. Grupările C = O și N-H ale legăturilor peptidice din lanțurile adiacente sunt în același plan și punct unul spre celălalt, formând legături de hidrogen între ele. Toate grupurile R din orice lanț pot să apară alternativ peste și sub planul foii.
Definiții:
Structura secundară: Este forma unei proteine pliante datorată legăturii de hidrogen între gruparea amidă a coloanei vertebrale și grupările carbonil.
Referințe: "Structura proteinelor". ChemWiki: Hypertextul chimiei dinamice "Structura secundară a proteinelor: α-Helices și β-Sheets". Proteinstructures. com de Salam Al Karadaghi "Chimie organică". Manualul de celule virtuale "Beta Sheet". Wikipedia Image Datorită "densității electronice a helixului myoglobina 2nrl 17-32" de către Dcrjsr - Activitate proprie (CC BY 3. 0) prin Wikimedia Wikimedia "Structura secundară a proteinelor" de en: Utilizator: Bikadi (CC BY-SA 3. 0) Commons Wikimedia "1gwe antipar beta Sheet ambele" de Dcrjsr - Muncă proprie (CC BY 3.0) prin intermediul Wikimedia Commons



