Diferență între 1s și 2s Orbital | 1s vs 2s Orbital
Diferența cheie - 1s vs 2s Orbital
Atom este cea mai mică unitate de materie. Cu alte cuvinte, toată materia este făcută din atomi. Un atom este compus din particule subatomice, în principal, protoni, electroni și neutroni. Protonii și electronii fac nucleul, care este situat în centrul atomului. Dar electronii sunt poziționați în orbitale (sau niveluri de energie) care sunt situate în afara nucleului unui atom. De asemenea, este important de menționat că orbitele sunt concepte ipotetice care sunt folosite pentru a explica locația cea mai probabilă a unui atom. Există diverse orbite care înconjoară nucleul. Există, de asemenea, sub-orbite cum ar fi s, p, d, f, etc. Sub-orbitalul s este în formă sferică atunci când este considerat ca o structură 3D. Orbita s are cea mai mare probabilitate de a gasi un electron in jurul nucleului. Un sub-orbital este din nou numerotat ca 1s, 2s, 3s, etc. în funcție de nivelurile de energie. Diferența cheie dintre orbitalul 1s și 2s este energia fiecărei orbite. Orbitalul 1s are o energie mai mică decât orbitalul 2s.
CUPRINS> 1. Prezentare generală și diferență cheie
2. Ce este 1s Orbital
3. Ce este 2s Orbital
4. Comparație comparație comparativă - 1s vs 2s Orbital
5. Rezumat
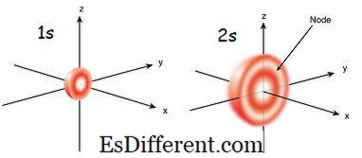
Ce este orbitalul 1s?
orbital este orbitalul care este cel mai apropiat de nucleu. Are cea mai mică energie între alte orbite. Este și cea mai mică formă sferică. Prin urmare, raza orbitalului este mică. Pot exista doar 2 electroni în orbitalul s. Configurația electronilor poate fi scrisă ca 1s
1 dacă există un singur electron în orbitalul s. Dar dacă există o pereche de electroni, poate fi scrisă ca 1s 2 . Apoi, cei doi electroni se deplasează în direcția opusă datorită repulsiei care se produce datorită acelorași încărcări electrice ale celor doi electroni. Când există un electron neparat, se numește paramagnetic. Acest lucru se datorează faptului că poate fi atras de un magnet. Dar dacă orbitalul este umplut și există o pereche de electroni, electronii nu pot fi atrasi de un magnet; acest lucru este cunoscut ca diamagnetic.
orbitalul 2s este mai mare decât orbitalul 1s. Prin urmare, raza sa este mai mare decât cea a orbitalului 1s. Este următoarea dulap orbital la nucleu după 1s orbital. Energia sa este mai mare decât orbita 1s, dar este mai mică decât alte orbite într-un atom. 2s orbital poate fi umplut numai cu unul sau doi electroni. Dar orbitalul 2s este umplut cu electroni numai după terminarea orbitalului 1s.Acesta se numește principiul Aufbau, care indică ordinea umplerii electronilor în sub-orbite.
Care este diferența dintre orbitalul 1s și 2s?
- diff Articol Mijloc înainte de masă ->
1s vs 2s Orbital
1s orbital este cel mai apropiat orbital la nucleu. |
|
| Orbitalul 2s este al doilea cel mai apropiat orbital la nucleu. | Nivelul energiei |
| Energia orbitalului 1s este mai mare decât cea a orbitalului 2s. | |
| 2s are o energie relativ mai mică. | Radiusul orbitalului |
| Raza orbitalului 1s este mai mică. | |
| Raza orbitalului 2s este relativ mare. | Dimensiunea orbitalului |
| 1s are cea mai mică formă sferică. | |
| orbitalul 2s este mai mare decât orbitalul 1s. | Umplerea cu electroni |
| Electronii sunt mai întâi umpluți în orbitalul 1s. | |
| Orbitalul 2s este umplut numai după terminarea electronilor în orbitalul 1s. | Rezumat - 1s vs 2s Orbital |
Un atom este o structură 3D care conține un nucleu aflat în centru, înconjurat de orbite diferite de diferite grade de energie. Aceste orbite sunt din nou împărțite în sub-orbite, în funcție de mici diferențe de energie. Electronii, care este o particulă subatomică majoră a unui atom, se află în aceste niveluri de energie. 1s și 2s sub-orbitale sunt cele mai apropiate de nucleu. Principala diferență între orbitalii 1s și 2s este diferența dintre nivelul lor de energie, care este, 2s orbital este un nivel de energie mai mare decât 1s orbital.
Referință:
1. Libretexts. "Orbitale atomice. "Chemistry LibreTexts. Libretexts, 03 noiembrie 2015. Web. 26 mai 2017..
2. Atomi, electroni și orbite. N. p., n. d. Web. 26 mai 2017..
Amabilitatea imaginii:
1. "S orbitale" (decupate) De CK-12 Foundation - Dosar: High School Chemistry. pdf, pagina 265 (CC BY-SA 3. 0) prin Wikimedia Commons


